Логинов П.
Институт биохимии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва
Эрнандес Е.
кандидат биологических наук, ИД «Косметика и медицина», Москва
Введение
На самой поверхности кожи лежит слой, образованный секретом потовых и сальных желез, — это так называемая мантия Маркионини (по имени ученого, впервые ее описавшего). Характерной особенностью мантии является кислая реакция — рН порядка 5,4-5,6 [1-3]. Но уже под роговым слоем — там, где есть живые клетки, рН становится 7,4. Градиент рн в пределах рогового слоя — важная составляющая гомеостаза, и в роговом слое существуют эндогенные механизмы, его создающие и поддерживающие. К ним относится фосфолипаза А₂, которая расщепляет фосфолипиды и высвобождает из них свободные жирные кислоты во внеклеточном пространстве рогового слоя [4]. Подкисление рогово- го слоя на уровне его нижней границы обеспечивает и работа натрий-протонной обменной помпы МНЕ (ее еще называют антипортером МНЕЛ) [5], находящейся в клеточных мембранах гранулярных кератиноцитов [5, 6]. Есть свидетельства наличия третьего механизма, действующего во внешнем эпидермисе: образование транс-уроканиновой кислоты в результате протеолиза филаггрина [7]. Филаг-грин — белок, играющий исключительно важную роль в процессе ороговевания, найден в гранулярных кератиноцитах. Он участвует в агрегации кератиновых тонофиламент, образуя между ними аморфный матрикс. К ним присоединяются белки, полисахариды, липиды, аминокислоты, которые высвобождаются при на- чинающемся здесь распаде ядер и органелл. В результате образуется сложное по составу соединение — кератогиалин, из которого в дальнейшем будет формироваться кератин, заполняющий роговые чешуйки. Мутации филаггрина отмечены у больных атопическим дерматитом, а также ихтиозом и синдромом Нетертона. Помимо всего прочего, у этих больных рН кожи выше нормы [8].
Традиционно кислый рН на поверхности рогового слоя связывают с бактерицидным действием [9]. Но теперь уже известно, что градиент рН необходим для нормального формирования рогового слоя.
К примеру, восстановление барьера замедляется, если поврежденные участки кожи обработать нейтральным буферным раствором, имеющим рН порядка 7 [10], а фармакологическая блокада, как и «выключение» (нокаут) генов фосфолипазы А, или антипортера МНЕТ, ухудшает работу барьера и целостность рогового слоя [3-5, 11]. Слабые барьерные свойства рогового слоя, характерные для кожи новорожденных, также объясняются тем, что у них эндогенный механизм закисления еще не отлажен, в том числе снижен уровень активности фосфолипазы А, [12, 13].
Отрицательные последствия нейтрализации рогового слоя связывают с активацией сериновых протеаз (СП), для которых оптимальный рН — нейтральный и слабощелочной [14]. Если в течение некоторого времени поддерживать высокую активность сериновых протеаз, то разрушаются ключевые ферменты, участвующие в сборке липидного барьера рогового слоя, — В-глюкоцереброзидаза и кислая сфингомиелиназа, а также страдают ферменты, ответственные за дегра- дацию корнеодесмосом [11, 13].
Другое неприятное следствие длительного повышения рН — ингибирование секреции ламеллярных гранул. Эти гранулы имеются в гранулярных кератиноцитах и содержат ферменты и липиды, из которых в нижних слоях рогового слоя начинается формироваться липидный барьер — прослойка, заполняющая пространство между корнеоцитами. Если процесс секреции ламеллярных гранул нарушен, то и сборка липидного барьера происходит неправильно, а значит, роговой слой будет плохо организован и перестанет адекватно выполнять свои функции [15].
Наконец, активация сериновых протеаз в роговом слое приводит к превращению проинтерлейкина-1В в активные метаболиты, что может стать причиной воспаления, если активность фермента сохраняется длительное время [16].
Для большей части воспалительных дерматозов характерна не только воспалительная реакция со всеми ее клиническими признаками, но и значительные нарушения барьерной функции кожи на уровне рогового слоя. Аномальное шелушение и колонизация поверхности кожи патогенными микроорганизмами могут быть следствием рН-индуцированного изменения активности сериновых протеаз и ферментов, участвующих в сборке липидного барьера.
Не только воспаленная, но и младенческая и возрастная кожа характеризуется повышением рн [17-19], причем во всех случаях проявляются негативные эффекты нейтрализации [18, 20]. Широко известно раздражение кожи при использовании щелочного мыла, вызванное в том числе активацией первичных цитоки- нов и повышением активности сериновых протеаз.
Регуляция рН в роговом слое с помощью топических средств
Восстановление баланса рН на поверхности кожи и его градиента в пределах рогового слоя при лечении воспалительных дерматозов может прервать порочный круг — не только улучшить барьер проницаемости, но и снизить колонизацию патогенами, а также снять воспаление. Эта идея сегодня активно обсуждается и исследуется, и уже получены результаты, поддерживающие ее жизнеспособ- ность. В этой связи большой интерес представляют данные, опубликованные в феврале 2010 года в журнале оита/оЁтуезИдайме Беттаю/оду. Группа исследователей под руководством Питера Элиаса в эксперименте на коже безволосых мышей показала, что быстрое и сильное селективное закисление нижних слоев рогового слоя улучшает созревание липидного барьера и тормозит деградацию корнеодесмосом [21].
В качестве закисляющих веществ были выбраны полигидроксикислоты — лакто- бионовая кислота и глюконолактон. Молекулярная масса этих кислот выше, чем обычных гидроксикислот, поэтому они не проходят сквозь роговой слой, а «за- стревают» в нем, влияя на рН только в пределах рогового слоя. Благодаря этому можно селективно менять градиент рН на разных уровнях рогового слоя и наблюдать ответную реакцию в самых верхних слоях эпидермиса.
Полигидроксикислоты снижают рН в толще рогового слоя
В эксперименте [21] были использованы тестовые препараты в кислой и нейтра-
лизованной форме:
— 10% раствор лактобионовой кислоты в среде пропиленгликоль/этанол (70/30) — кислый (ЛБК, рН 2,8) и нейтрализованный (нЛБК, рН 7,0);
— 10% раствор глюконолактона кислоты в среде пропиленгликоль/этанол (70/30) — кислый (ГЛ, рН 3,2) и нейтрализованный (нГЛ, рН 7,0).
Растворы однократно наносили на кожу, после чего измеряли уровень рН с помощью специального плоского электрода. Оказалось, что кислые препараты
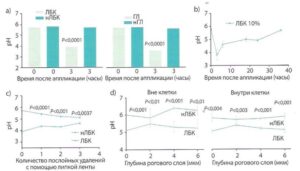

Время после апплекаций (часы)
Рис. 1. Применение ПГК приводит к устойчивому снижению рн рогового слоя мыши на всех его уровнях [21]:
а) снижение рнН рогового слоя по прошествии 3 часов после аппликации кислых препаратов ПГК (ЛБК и ГЛ) значительное по сравнению с нейтрализованными ПКГ (нЛБК и нГЛ);
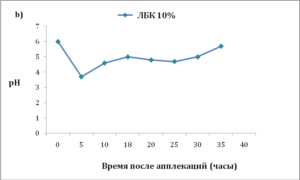
Ь) рНна поверхности рогового слоя восстанавливается через 16-35 часов после применения ЛБК;
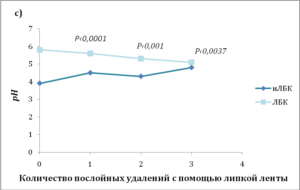
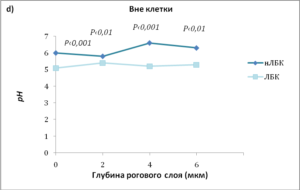
- c) ЛБК-индуцированное закисление распространяется в глубь рогового слоя, что показано измерениями рН поверхности после стриппинга липкой лентой;
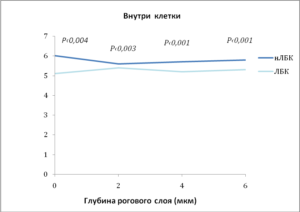
- d) измерения с помощью флуоресцентной микроскопии показывают, что применение ЛБК снизило рН как в цитозольных (внутриклеточных), так и в мембранных (внеклеточных) доменах. Приведены средние + стандартная ошибка (п = 4-6).
значительно снижали поверхностный рН по сравнению с использованием ней- трализованных растворов ЛБК — нЛБК, нГЛ или среды (рис. 1a и b).
Со временем наблюдалось восстановление рН до исходного уровня, но этот процесс был не быстрым и протекал в течение 16-35 часов после однократной аппликации (рис. 1b и 2). Участки кожи, обработанные ПГК или кислотным буфером, не показали никаких признаков раздражения, что определялось визуально (по отсутствию видимого воспаления), гистологически (по отсутствию эпидермальной гиперплазии и дермального воспаления) и биофизически (по отсутствию изменений индекса трансэпидермальной потери воды, ТЭПВ).
Аппликация кислого раствора привела к снижению рн во всей толще рогового слоя, а не только на его поверхности. Это было показано путем послойного удаления рогового слоя с помощью липкой ленты (стриппинг) (рис. 1c).
Чем дальше от поверхности кожи и ближе к границе с гранулярным слоем, тем выше рн. Но оказалось, что на одной и той же глубине рН также неоднороден. Обнаружены участки, которые остаются закисленными даже в нижних слоях рогового слоя, прилегающих к гранулярному. Эти «кислые» точки удалось «увидеть» с помощью флуоресцентной микроскопии, оказалось, что это определенные участки мембран — мембранные микродомены, в которых уровень рН поддерживается низким в отличие от их ближайшего окружения. Обработка кожи кислым препаратом ЛБК в отличие от его нейтрализованной версии снизила рН на всех уровнях рогового слоя, причем в мембранных микродоменах нижних слоев это снижение оказалось значительным (рис. 1d и 2). При этом важно отметить, что в целом рН нижележащих слоев не изменяется (рис. 2).
Гиперацидификация кожи после острого повреждения ускоряет восстановление липидного барьера.
Динамику восстановления барьерных свойств определяют с помощью теваметрии — биофизического метода, оценивающего индекс трансэпидермальной по- тери воды (индекс ТЭПВ).
Рис. 2. Исследование с помощью флуоресцентной микроскопии [21]
Неповрежденный роговой слой, обработанный ЛБК и нЛБК (контроль). Приведены изобра- жения пяти оптических слоев, начиная с поверхности кожи до гранулярного слоя (8 мкм). ОН оценивали с помощью измерения времени жизни рН-чувствительной флуоресцентной метки. Два нижних ряда — распределение интенсивности свечения метки; два верхних ряда — измерения времени жизни. Голубым цветом отмечены нейтральные значения рН, а зеленым и желтым — кислотные. Аморфные скопления областей с низким РН заметны на участках, обработанных ЛБК, но не нЛБК. Закисление внеклеточных областей наблюдается в роговом слое, обработанном ЛБК, но на срезах уровня гранулярного слоя оно практически незаметно. Полоска в правом нижнем углу = 10 мкм.
В работе [21] кожу повреждали путем стриппинга — послойного удаления рогового слоя с помощью липкой ленты. Тестовые препараты наносили на участки с поврежденным барьером сразу после стриппинга, а также на контрольные неповрежденные участки, симметрично расположенные на другом боку мыши. Индекс ТЭПВ измеряли сразу после повреждения, а также спустя 3 часа после нанесения препаратов.
В местах, обработанныхЛБК или ГЛ, восстановление барьера значительно ускорилось по сравнению с участками, обработанными нейтрализованными ПГК (нПГК) или только средой (рис. 3). Исходя из того, что скорость восстановления барьера при использовании нПГК и среды одна и та же, был сделан вывод, что сами по себе молекулы ПГК не оказывают какого-либо специфического действия на клетки, а служат лишь регуляторами рн. И основным фактором, улучшающим восстановление, является поддерживаемое ими закисление рогового слоя.
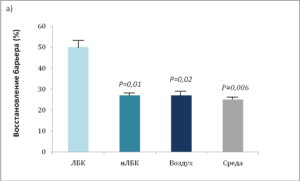
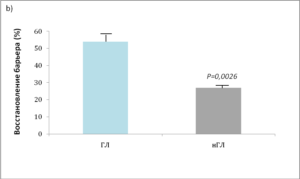
Рис. 3. Гиперацидификация ускоряет вос- становление барьера в коже мыши [21]
Индекс ТЭПВ измеряли перед повреждени- ем (0) ипо прошествии 3, 24 и 48 часов после острого повреждения барьера с помощью повторяющего стриппинга липкой целло- фановой лентой. Однократное применение 10% кислого раствора ЛБК (а) или ГЛ (Б) сра- зу после стриппинга существенно ускоряло восстановление барьера в течение 3 часов после нарушения его работы по сравнению с применением нЛБК, среды, нГЛ или остав- ления на воздухе. Приведены средние + стандартная ошибка (п = 4-6).
В чем же причина ускоренного восстановления кожи? В поисках ответа на этот вопрос было проведено сравнение секреции ламеллярных телец через 3 часа после нанесения кислых и нейтральных растворов полигидроксикислот. Оказалось, что в участках, обработанных кислым раствором ЛБК, ускорено созревание липидного барьера между корнеоцитами (рис. 4а, справа, отмечены стрелками). Это обусловлено повышением активности двух ключевых ферментов, участвую- щих в сборке барьера, — В-глюкоцереброзидазы и кислой сфингомиелиназы, оптимальный рН для которых находится в области кислых значений.
С помощью зимографии т 5Йи было установлено, что активность обоих ферментов в нижнем роговом слое увеличилась вследствие гиперацидификации кислым раствором ПГК, проведенной после резкого нарушения барьера (рис. 4b).
Рис. 4. Ускорение восстановления барьера при гиперацидификации связано с более быстрым созреванием ламеллярных мембран, возникающим в результате активизации работы ферментов В-глюкоцереброзидазы и кислой сфингомиелиназы:
а) нанесение кислого раствора ЛБК сразу после повреждения с помощью стриппинга на кожу ускоряло формирование липидного барьера на границе гранулярного и рогового слоев (показаны белыми стрелками в правой части) в отличие отнЛБК. Через 3 часа после повреждения. Пост-фиксация RuО₄. Полоска в нижнем левом углу = 200 нм;
Ь) ускоренное созревание липидного барьера обусловливается увеличением in situ активности работы ферментов В-глюкоцереброзидазы и кислой сфингомиелиназы. Повышение активности этих ферментов связано с закислением, и после нейтрализации активность возвращается к норме.
Обозначения: SC (stratum corneum) — роговой слой; SG (stratum granulosum) — гранулярный слой; LВА ([lactobionic acid) — лактобионовая кислота; nLBA — нейтрализованная лактобионовая кислота; LBA + in situ neutralization — нейтрализация лактобионовой кислоты после нанесения на кожу.
В коже, обработанной нейтральным раствором, такого не наблюдалось. Более того, увеличение активности этих ферментов, связанное с закислением эпидермиса, исчезло, когда области, подвергнутые гиперацидификации, были вторично нейтрализованы (рис. 4Ь, нейтрализация in situ).
Гиперацидификация улучшает целостность рогового слоя и уменьшает скорость десквамации
Путем определения степени когезии (сцепления) роговых чешуек и индекса ТЭПВ определяют целостность рогового слоя и его барьерные свойства. Эти методы были использованы для того, чтобы оценить влияние ПГК на кожный барьер. Оказалось, что кислые растворы обеих ПГК достоверно укрепили роговой слой. Примечательно, что эффект укрепления оказался наиболее выражен не на поверхности, а в толще рогового слоя — здесь связь между роговыми чешуйка- ми упрочилась после аппликации кислых растворов ПГК (рис. 5).
Чем можно объяснить этот эффект? Физиологический процесс разрушения корнеодесмосом начинается на 1-2 слоя выше границы рогового и гранулярного слоев, но в участках, обработанных ПГК, они сохранились в среднем и даже внешнем роговом слое (рис. 6а и b). Это было также подтверждено количественной электронной микроскопией — микрофотографии показали значительное увеличение плотности корнеодесмосом в нижнем роговом слое после гиперацидификации (рис. 6b).
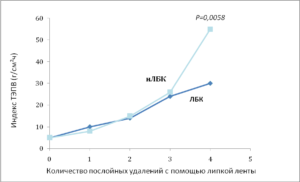

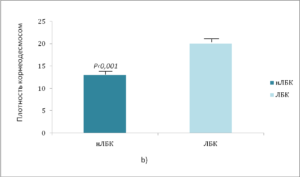
Рис. 5. Предварительное закисление улучшает барьерную функцию рогового слоя [21]:
После однократного нанесения ЛБК или ГЛ целостность нижнего рогового слоя заметно улучшилась. Приведены средние +/- стандартная ошибка (n = 4-6).
Рис. 6. Плотность корнеодесмосом увеличивается после закисления рогового слоя [21]
а) данные количественного анализа фотографий электронной микроскопии показывают значительное увеличение плотности корнеодесмосом на коже, обработанной ЛБК, по сравнению с обработкой нЛБК;
Ь) количество КД (обозначены стрелками) увеличивается, и нижний роговой слой выглядит более плотным в участках, обработанных ЛБК, что подтверждается увеличением количества внутрикорнеоцитных «крючков» (показаны звездочками). Полоска = 0,25 мкм.
Специальное исследование активности сериновых протеаз, ответственных за разрушение корнеодесомосом, показало, что при гиперацидификации их ферментативная активность подавлена (рис. 7).
Рис.7. Длительное закисление нормальной кожи приводит к снижению активности сериновых протеаз (зеленое свечение) и активации калликреинов-5 и -7 (красное свечение)
Обозначения: SC ((stratum corneum) — роговой слой; SG (stratum granulosum) — гранулярный слой; LBA (lactobionic acid) — лактобионовая кислота; nLBA — нейтрализованная лактобионовая кислота; LBA + in situ neutralization — нейтрализация лактобионовой кислоты после нанесения на кожу.
Что касается аспартатных и цистеиновых протеаз, также присутствующих в роговом слое, но имеющих оптимум в кислом диапазоне рН [23, 24], то оказалось, что их активность практически не изменилась [21]. Это свидетельствует о том, что одного закисления для существенного влияния на эти ферменты недостаточно.
Обсуждение
В норме острые нарушения барьера проницаемости запускают метаболический «ответ» в нижних слоях эпидермиса, приводящий к быстрому восстановлению барьерной функции. Среди механизмов такого ответа — быстрая секреция запасенных в гранулярных кератиноцитах ламеллярных телец [27, 28] и стимуляция синтеза липидов [27, 29]. Этот начальный каскад приводит к частичному восстановлению барьера, а в дальнейшем к процессу восстановления присоединяются и другие механизмы.
- Повышение экспрессии эпидермальных церамидов [30].
- Интенсивная экспрессия липидперерабатывающих ферментов [31], в первую очередь — В-глюкоцереброзидазы [32].
- Индукция синтеза ДНК в кератиноцитах [33].
Восстановление барьера занимает в среднем порядка 35 часов [27, 29], так что ответ кожи на острое повреждение весьма быстрый. Закисление поверхности кожи ускоряет восстановительные работы. Но не каждую кислоту можно использовать с этой целью. Полигидроксикислоты по сравнению с обычными гидрокси-кислотами в плане безопасности имеют явные преимущества, так как они благодаря большому размеру не проходят сквозь барьер и локализуются в пределах рогового слоя, поддерживая в его толще рН на более низком уровне.
Улучшение функционирования рогового слоя после внешнего закисления связано не только с понижением рн во всей толще рогового слоя, но и с понижением рН конкретно в «кислых» точках — мембранных микродоменах, имеющихся на уровне границы зернистого и рогового слоев. Было показано, что при понижении поверхностного рН менее 5 активировались два важнейших фермента, участвующих в созревании липидного барьера, — В-глюкоцереброзидаза и кислая сфингомиелиназа [34, 35]. Примечательно, что эти ферменты расположены в мембранных микродоменах в нижнем роговом слое, т.е. удалены от поверхности кожи [3, 25, 34]. Этот эффект, в свою очередь, ускоряет секрецию содержимого ламеллярных гранул во внеклеточное пространство, где начинается сборка липидного барьера.
Кроме того, снижение поверхностного рН рогового слоя улучшает его целостность и связность. Это обусловлено снижением активности сериновых протеаз до практически неопределяемого уровня. Такой эффект связан с тем, что оптимум рН для сериновых протеаз в общем и калликреинов -5 и -7 в частности лежит в нейтрально-лабощелочной области [14]. Хотя в эпидермисе содержится целый ряд калликреинов, именно эти две протеазы наряду с недавно описанным калликреином-8 [36] являются наиболее распространенными ферментами, отвечающими за деградацию корнеодесмосом и процесс десквамации [14, 38].
При нейтрализации закисленного рогового слоя активность сериновых протеаз возвращается на прежний уровень или даже повышается, поэтому можно утверждать, что снижение их активности не связано с изменением их содержания. Наблюдаемые изменения активности сериновых протеаз объясняют положительное влияние гиперацидификации на скорость отшелушивания клеток. В работе [39] показано, что в результате 3-недельного применения 4% раствора гликолевой кислоты разрушение десмосом ускорилось только в самых поверхностных слоях рогового слоя (5таит ип ит) ‚ в то время как десмосомы в таит сотрабит остались нетронутыми. Также в работе [40] применялись 5% гликолевая и молоч- ная кислоты (нанесение на 14 дней на бока безволосых мышей) и было показано снижение толщины рогового слоя в участках нанесения кислот.
Надо отметить, что в роговом слое есть и другие типы протеаз — цистеиновые и аспартатные, оптимум рН для которых находится в кислотной области (катепсин О, Е, |2) [19, 25]. В связи с этим встает вопрос: может ли быть так, что гиперацидификация РС ускоряет отшелушивание благодаря активации катепсинов. Однозначного ответа пока нет, и мнения исследователей различаются. Так, в работе [21] было установлено, что закисление само по себе не повышает активность катепсина О. Эти результаты противоречат другим работам, в которых показано, к примеру, что применение гликолевой кислоты ускоряет отшелушивание вместе с повышением уровня катепсина О во внешнем роговом слое [41]. Однако в [41] применялась гликолевая кислота в 50% концентрации, которая снизила рН поверхности до 2, и, возможно, ускорение отшелушивания было токсическим эффектом. Увеличение концентрации катепсина О приводит к активации трансглутаминазы-1, которая стимулирует образование рогового конверта [26], но, возможно, у этого фермента есть и другая, важная для функционирования барьера мишень. Катепсин 12 (цистеиновая протеаза) тоже имеет оптимум в кислотном диапазоне рН, и он также экспрессируется как профермент в нижнем роговом слое, после чего активируется с помощью невыясненного механизма в верхних его слоях [19]. Таким образом, похоже, что одна только гиперацидификация не может активировать катепсин |2. В целом можно довольно уверенно предполагать, что закисление рогового слоя оказывает значительное влияние на активность сериновых протеаз, отвечающих за отшелушивание, в то время как аспартатные и цистеиновые протеазы остаются в общем незатронутыми.
Тем не менее теоретически гиперацидификация могла бы оказывать и негативное влияние на барьер проницаемости, так как она снижает активность другого важнейшего липидоперерабатывающего фермента, оптимум которого находится в нейтральной и слабощелочной области, — фосфолипазы А₂. Но в эксперименте мы это не наблюдали. Этот парадокс можно объяснить тем, что сама по себе работа фосфолипазы А₂‚ приводящая к повышению уровня свободных жирных кислот и таким образом улучшающая структуру и работу барьера проницаемости, и есть естественная гиперацидификация [13]. Таким образом, экзогенная гиперацидификация не может оказывать негативный эффект из-за снижения активности фосфолипазы А₂. Следует также отметить, что закисление смеси физиологических липидов церамид/холестерин/свободные жирные кислоты in vitro улучшает ее абсорбцию в роговом слое [42], что, возможно, является еще одним способом укрепить роговой слой путем аппликации «правильного» топического препарата.
Эффект закисления в косметологии и вопросы выбора
Применение гидроксикислот в средствах для пилинга и других косметических продуктах широко распространено в лечении таких дерматологических состояний, как фотоповреждение/фотостарение [43], врожденный [44] или приобре- тенный [45] гиперкератоз.
В работе [46] на предплечье в течение 6 месяцев наносили 25% гликолевую, молочную или лимонную кислоту, что привело к утолщению кожи в среднем на 25%. Авторы этой работы сделали вывод, что применение а-гидроксикислот значительно снижает выраженность эпидермальных и дермальных признаков фотостарения. В [47] показано, что местное применение молочной кислоты (4% в водной среде) улучшает барьерную функцию рогового слоя человека наряду c повышением уровня церамидов.
В работе [48] использовалась более низкая концентрация ПГК для того, чтобы остаться в физиологическом диапазоне рН. Было показано, что закисление мембранных доменов нижнего рогового слоя улучшает работу липидперерабатывающих ферментов — β-глюкоцереброзидазы и кислой сфингомиелиназы, что в свою очередь улучшает переработку липидов и приводит к повышению уровня церамидов в роговом слое.
Как в [47], так и в [48] было показано, что разные кислоты оказывают разный эффект на барьер проницаемости. Это может быть связано с различной биологической доступностью этих кислот внутри мембранных доменов рогового слоя или с образованием солей при нейтрализации используемых кислот. Что касается экспе- римента, описанного в работе [21], то его целью было определение исключительно эффекта закисления, поэтому в качестве контроля использовался уже готовый нейтрализованный раствор ПГК (это позволило избежать реакции образования солей непосредственно в роговом слое, которая могла бы повлиять на результат).
В целом можно утверждать, что гиперацидификация укрепляет барьер в большой степени за счет регуляции активности ферментов, ответственных за переработку липидов и отшелушивание клеток. Более того, понижение рН не приводит ни к воспалёнию, ни к гиперплазии, ни к изменениям синтеза липидов эпидермиса, что лишний раз доказывает тот факт, что закисление с помощью препаратов полигидроксикислот не влияет на глубокие слои эпидермиса. Присутствие же полигидроксикислот в пределах рогового слоя подтверждено методом флуоресцентной микроскопии.
Итак, очевидно, что искусственное закисление кожи — эффективный способ повлиять на ее барьерные свойства. Гиперацидификация благотворно влияет на структуру и функции рогового слоя даже при нормальном состоянии эпидермиса. Исследования последних лет дают основание для использования ацидотерапии в качестве метода лечения воспалительных дерматитов, характеризующихся нарушениями барьерных функций целостности рогового слоя и поверхностного рН (например, атопического дерматита и акне).
Важно отметить нижнюю границу рН препарата, который может оставаться в контакте с кожей на длительное время, — это 3,5. Если рН ниже, то препарат необходимо тщательно удалить или нейтрализовать, иначе может развиться кислотный ожог кожи. Согласно ЕВА, препараты, имеющие рН < 3,5, относят к медицинским и используют для пилинга в условиях косметологической клиники.
Подбор соответствующего закисляющего агента не менее важен. В этой связи полигидроксикислоты представляются перспективными веществами, поскольку не проникают ниже рогового слоя и осуществляют регуляцию градиента рН в его пределах. Действие полигидроксикислот вполне физиологично для кожи и не приводит к развитию токсических эффектов. Сегодня эти соединения с успехом используют для улучшения состояния барьерных свойств кожи даже в случае таких тяжелых заболеваний, как ихтиоз.